通过结构设计及表面修饰,磁性复合微球可用于磁靶向药物输送、磁热疗和磁共振成像、蛋白质多肽的磁分离纯化等,为生物医学研究的快速发展提供了新手段和新技术。课题组在生物医用强劲需求的牵引下,深入研究了磁性纳米材料和环境响应性高分子复合微球的合成方法、结构调控、功能整合和应用探索。基于功能模块组装的思路,建立了灵活、普适的模块化方法,将温敏、pH敏感、多孔性、荧光等功能与磁性材料整合,开发了核壳、响铃、空心等形态的复合微球,研究了组成功能模块间的协同作用,进而展示了其在靶向药物输送、蛋白多肽的分离纯化等方面的优异性能。
构筑智能磁性复合微球药物载体:基于功能模块组装的思路,分别以硅基硬模板、胶束软模板和蒸馏沉淀聚合等方法,将不同性质的环境响应高分子水凝胶、功能纳米材料、多孔材料与磁性纳米粒子复合,体现了多功能间协同作用的效果,特别是在药物的负载以及控释方面,我们逐步深入的研究了提高药物负载能力以及多种环境响应条件下的药物控释行为。例如通过聚谷氨酸诱导合成的多孔Fe3O4簇状粒子,其多孔结构可以大大提高药物的负载量,对于疏水药物紫杉醇,其载药率达到35%,在pH=7.4时的药物累积释放量为17.1%,而在pH=5.0时,由于磁簇被酸刻蚀而缓慢降解,导致药物的累积释放明显增加,48小时后释放量接近100%,展示了pH响应的释放行为以及载体的可降解性,为其生物医用奠定了良好的基础。相关研究获得了国家重点研发项目的资助(基金号:21474017; 2016YFC1100300)。

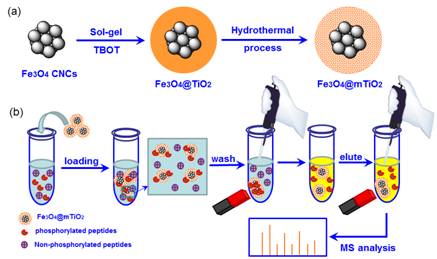
磁性复合微球在蛋白多肽的选择性富集的应用:蛋白的磷酸化及糖基化等是蛋白的重要翻译后修饰过程,在许多复杂的生物过程如细胞的生长、分裂和信号传递中都起到重要的作用。质谱是分析相关翻译后修饰过程的重要和有效工具,前提是能够在复杂体系中选择性富集出翻译后修饰蛋白,才能保证质谱分析的可靠性。相比于传统的固定金属亲和色谱法,磁分离技术更加简单、高效,而且富集纯度、特异性更好。例如,我们将Fe3O4超级磁性纳米粒子为核、结晶的多孔二氧化钛为壳层的磁性复合微球用于磷酸化蛋白的选择性富集和分离,该类磁性介孔二氧化钛复合微球在富集磷酸肽中显示了极高的选择性(1:1000)和灵敏度(fmol/μL)、优异的富集容量(225 mg/g)和富集回收率(93%),展现了在蛋白质组学分析中极其重要的应用前景。该方面的技术在标志物检测方面也具有极好的应用前景。相关研究获得了国家863项目的资助(基金号:2012AA020204)。
